Simulador online
Simulador de trabajo: EMF measurement (Simulator) : Physical Chemistry Virtual Lab : Chemical Sciences : Amrita Vishwa Vidyapeetham Virtual Lab
se recomienda utilizar una cuenta de correo formal y utilizar una clave única (por favor anotarla, porque la va a usar cada vez que entre al simulador)
Paso a paso para trabajar dentro del simulador:
- Ajuste la temperatura.
- Seleccione el cátodo de la lista.
- Seleccione el ánodo de la lista.
- Seleccione la concentración del electrolito.
- Registre el voltaje de la celda.
- Calcule la energía libre de Gibbs a partir del voltaje obtenido del experimento.
- Calcula la constante de equilibrio.
- Predecir la espontaneidad de la reacción celular.
Observaciones y cálculos:
Temperatura =.............................. o C
Cátodo utilizado =......................
Concentración de electrolito =................... M
Ánodo utilizado =..........................
Concentración de electrolito =................... M
Por lo tanto, EMF de la célula =......................... V
El cambio de energía libre de Gibb de la reacción celular,
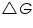 =......................
=......................
La constante de equilibrio de la reacción celular, 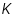 =.............................
=.............................
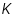 =.............................
=.............................La espontaneidad de la reacción celular =................................
Resultados:
- La fem de la célula =......................... V
- El cambio de energía libre de Gibbs de la reacción celular =......................
- La constante de equilibrio de la reacción celular =.............................
- La espontaneidad de la reacción celular =................................
Celda de Daniell: Seleccionaremos Cu(s) como cátodo, (donde se realiza la reducción) y como ánodo, (donde se realiza la oxidación), Zn(s). Los electrolitos en ambas semiceldas serán una solución de cobre de la misma concentración.
Oros tipos de celdas: Escogiendo temperatura de 25ºC, seleccionaremos Cu(s) como cátodo, (donde se realiza la reducción) y como ánodo, (donde se realiza la oxidación), seleccionaremos electrodos metálicos de Al, Sn, Ni, Ag, Fe, Au y Pb. Previamente realizaremos el cálculo de potencial de celda de cada combinación de electrodos, utilizando la tabla de potenciales de reducción estándar y la ecuación: Eºcelda= Eºcátodo -Eºánodo.
https://estudiantesdequimica1.blogspot.com/p/tabla-de-potencial-estandar-de-reduccion.html
Luego compararemos el valor de potencial de celda con el que nos arroja el simulador amritta. (De igual forma, dentro de la simulación podemos seleccionar diferentes tipos de electrodos y corroborar el potencial de celda con el obtenido con la ecuación antes mencionada)

Para realizar los cálculos pertinentes utilizar la tabla de potenciales del enlace: https://estudiantesdequimica1.blogspot.com/p/tabla-de-potencial-estandar-de-reduccion.html
ResponderBorrar